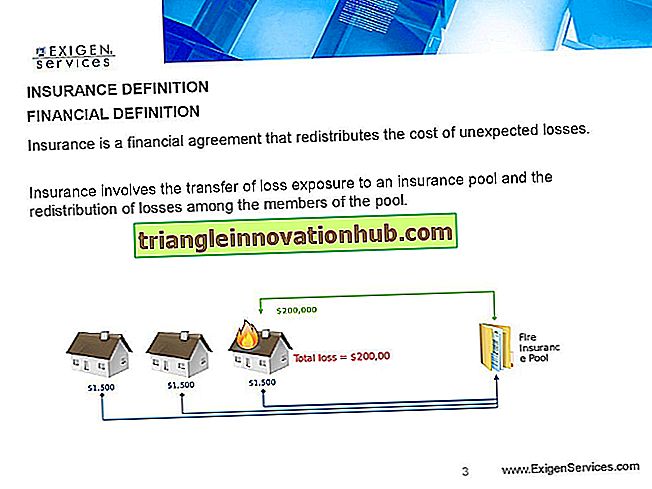
Western Blotting of Proteins
Western blotting białek!
Białka denaturuje się przez inkubację z detergentem jonowym (SDS: dodecylosiarczan sodu) w temperaturze 100 ° C.
SDS jednolicie powleka wszystkie białka i sprawia, że ładunek powierzchniowy białek jest ujemny.
↓
Denaturowane białko jest następnie poddawane elektroforezie w żelu poliakryloamidowym. Białka są rozdzielane jako odrębne prążki w zależności od ich ciężaru cząsteczkowego.
↓
Rozdzielone białka są elektroforetycznie przenoszone na bibułę filtracyjną (nylon lub nitrocelulozę).
↓
Bibułka filtracyjna jest następnie inkubowana z surowicą odpornościową przeciw białkom. Przeciwciała wiążą się z odpowiadającymi im antygenami białkowymi na bibule filtracyjnej i tworzą kompleksy antygen-przeciwciało.
↓
Bibułę filtracyjną przemywa się w celu usunięcia niezwiązanych składników surowicy.
↓
Znakowana enzymem anty-immunoglobulina (znana jako koniugat) jest dodawana do bibuły filtracyjnej i inkubowana.
↓
Koniugat wiąże się z przeciwciałem w kompleksie antygen-przeciwciało w bibule filtracyjnej.
↓
Bibułę filtracyjną przemywa się w celu usunięcia niezwiązanego koniugatu i dodaje się substrat i inkubuje.
ja. Kolorowe prążki rozwijają się w miejscach, w których występują kompleksy antygen-przeciwciało.
iii. Brak rozwoju pasma sugeruje, że odpowiednie przeciwciało przeciw antygenowi nie występuje w badanej surowicy.
Papiery filtracyjne impregnowane antygenami mogą być przechowywane przez dłuższy czas.
Test Western blot jest szeroko stosowany do wykrywania przeciwciał wirusa zapalenia wątroby typu C i jako test potwierdzający do wykrywania przeciwciał przeciwko ludzkiemu wirusowi niedoboru odporności (HIV).
Firmy handlowe impregnują papiery filtracyjne z oddzielonymi antygenami HIV i dostarczają je do laboratoriów. W laboratorium surowica pacjenta jest dodawana do bibuły filtracyjnej i przetwarzana w celu wykrycia obecności przeciwciał specyficznych względem HIV w surowicy.
Test radioimmunologiczny:
Radioimmunoassay (RIA) został opracowany przez Rosalin Yalow i Berson (1959). Wprowadzono wiele odmian metody. Istnieją dwie główne techniki RIA, konkurencyjna RIA i niekompetycyjna RIA.
Jako etykiety stosowane są różne radioizotopy (tabela 27.4), a emisje radioaktywne mierzone są w kategoriach zliczeń na minutę (CPM) za pomocą licznika scyntylacyjnego. Najpopularniejsza etykieta, 125 I, wymaga krótszego czasu na zliczanie sygnałów, ale ma ograniczony okres trwałości ze względu na krótki okres półtrwania. Radioizotop trytu ( 3 H) wymaga dłuższego czasu do zliczania, a zatem całkowity czas testu jest zwiększony.
Zalety OSR to:
ja. Precyzja i wysoka jakość
ii. Koniugacja izotopów jest łatwa
iii. Wykrywanie sygnału bez optymalizacji
Tabela 27.4: Właściwości radioizotopów stosowanych w teście radioimmunologicznym:
Izotop | Pół życia | Rodzaj rozpadu | Specyficzna aktywność (mCi / μmol) |
125 I | 60 dni | γ | 2200 |
131 I | 8, 1 dni | Β-, γ | 16, 100 |
3 H | 12, 3 lat | β- | 29 |
14 C | 5760 lat | β- | 6062 |
32 p | 14, 3 dni | β- | 9120 |
Jednak RIA ma następujące wady
ja. Krótki okres półtrwania odczynników
ii. Zagrożenia radioaktywne.